CFDA:2018年起,進口藥械入國門前要“安檢”!
自2011年起,CFDA就開始對進口藥品開展境外生產現場檢查,先后派出7個檢查組,赴美國、法國、意大利等國對7個品種的生產展開飛檢。
隨后,境外“飛檢”力度逐年加強,到2016年,50個進口藥品納入。
12月28日,國家食品藥品監督管理總局(CFDA)又發布《藥品醫療器械境外檢查管理規定(征求意見稿)》,擬在2018年建立對進口藥品、進口醫療器械境外生產現場“飛檢”制度。
目前,上述《規定》公開征求意見,截止日期為2018年1月24日。

規定指出,境外檢查工作主要針對于已在境內上市或者擬在境內上市的藥品、醫療器械的境外研制及生產的檢查,目的是為保證進口藥品、醫療器械境外研制、生產的真實性、安全性、可靠性和合規性,規范藥品、醫療器械境外檢查工作。
規定指出通過風險評估和隨機抽查的方式進行公開檢查。風險評估主要考慮藥品、醫療器械的注冊審評審批、日常監管、進口檢驗、投訴舉報、藥品不良反應監測、醫療器械不良事件監測等風險信息,從而確定檢查計劃。
規定中特別強調有下列情形之一的,視為進口廠商拖延、阻礙、逃避或拒絕檢查,檢查結論直接判定為“不符合要求”
(一)收到《藥品、醫療器械境外檢查告知書》后,未在規定時限內答復或者拒不提供相關文件、資料的;
(二)被檢查進口廠商無正當理由2次推遲檢查的;
(三)被檢查進口廠商無正當理由拒不安排動態生產的;
(四)不配合辦理境外檢查手續的,境外機構拒絕簽發入境許可的;
(五)不配合開展延伸檢查的;
(六)拖延、阻礙、限制、拒絕檢查人員進入被檢查場所或者區域的,或者限制檢查時間的;
(七)拖延、拒絕提供或故意掩蓋關鍵檢查信息的;
(八)拒絕或限制現場檢查取證工作的;
(九)其他不配合檢查的情形。
這周四,也就是2018年1月4日,CFDA將在北京召開藥品境外檢查工作企業通氣會,拜耳、輝瑞、默沙東、艾伯維、勃林格殷格翰等外資藥企的33個藥品,被納入2018年CFDA境外“飛檢”計劃,其中包括注射用替加環素(泰閣)等王牌藥品,也有四價人乳頭瘤病毒疫苗(佳達修)等今年剛過審批在中國上市的明星藥品,還包括一些已經納入優先審評“綠色通道“,即將在中國上市的藥品。
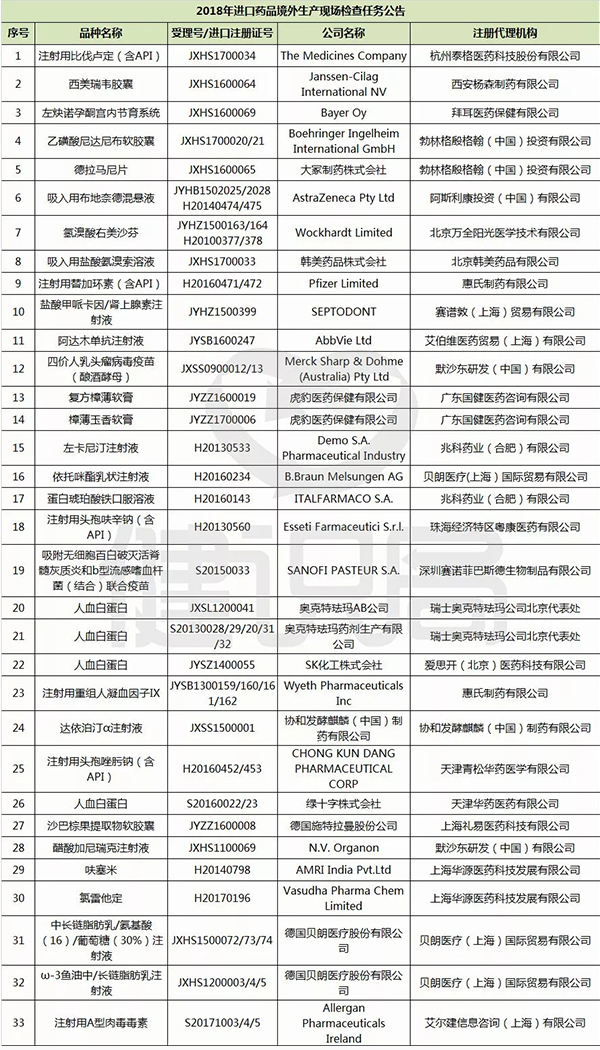
可以看出,2018對于境外產品的檢查制度將會越來越嚴格,希望大家注意哦~
【來源:CFDA】

相關閱讀
- CFDA發文,境外醫械大檢查來了2017-12-29






